Gas ideal
Un gas ideal es un conjunto de átomos o moléculas que se mueven libremente sin interacciones. La presión ejercida por el gas se debe a los choques de las moléculas con las paredes del recipiente. El comportamiento de gas ideal se tiene a bajas presiones es decir en el límite de densidad cero. A presiones elevadas las moléculas interaccionan y las fuerzas intermoleculares hacen que el gas se desvíe de la idealidad
Ley de los gases.
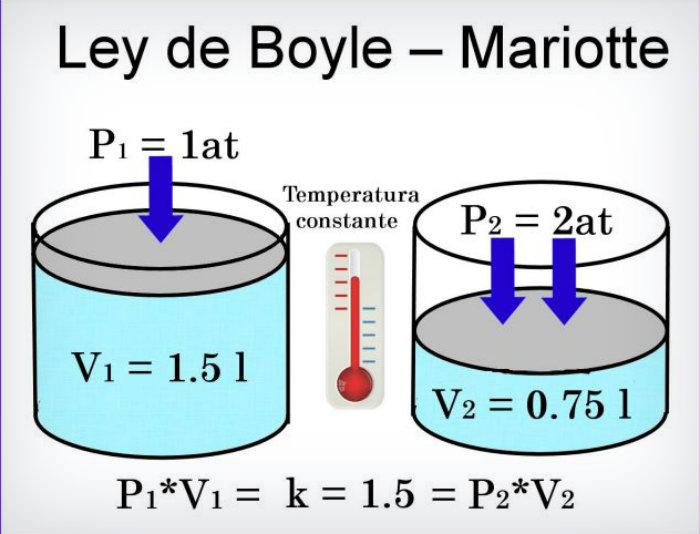
Ley de Boyle
La
presión que ejerce una masa gaseosa, es inversamente promocional a
su volumen,
siempre y cuando su temperatura sea constante.
Formula
Ley de Charles.
El
volumen de un gas es directamente proporcional a su temperatura
absoluta, si la
presión permanece constante.
Formula.
Ley de Gay-Lussac.
La
presión de un gas es directamente proporcional a su temperatura, si su
volumen
es constante.
Formula
P1/T1=P2/T2





:v
ResponderBorrar